Anvisa aprova procedimento que pode acelerar registro de vacinas de covid
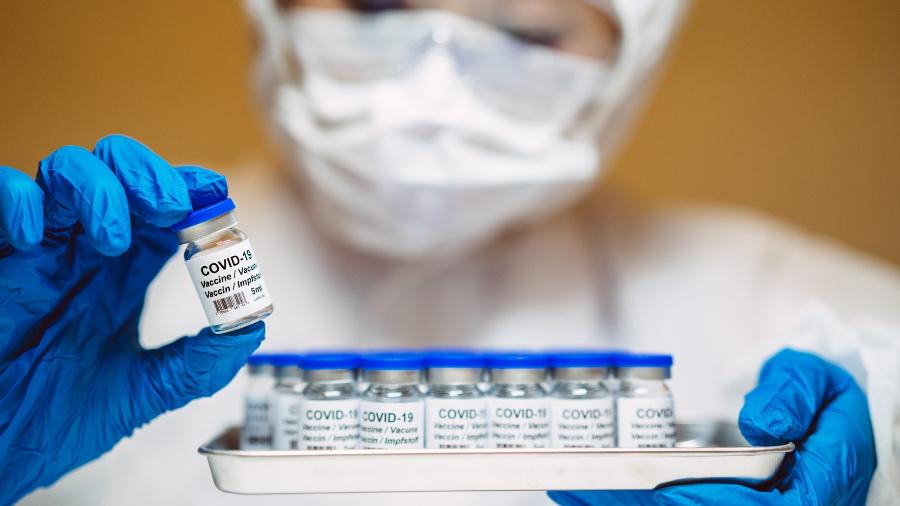
A Anvisa (Agência Nacional de Vigilância Sanitária) definiu os procedimentos de submissão contínua de dados técnicos para o registro de vacinas contra a covid-19. Na prática, a medida vai permitir que as empresas que desenvolvem imunizantes compartilhem com a agência informações sobre os estudos de maneira contínua e parcial, agilizando a análise dos laudos pela agência regulatória.
A Instrução Normativa nº 77/2020 foi aprovada ontem (17) pela diretoria colegiada do órgão e publicada hoje (18) no Diário Oficial da União.
Segundo a Anvisa, os diretores também dispensaram a análise de impacto regulatório e consulta pública para o registro devido ao grau de urgência da vacina e gravidade da doença.
"A medida possibilitará acelerar a disponibilização à população brasileira de vacinas contra o novo coronavírus, desde que demonstradas qualidade, segurança e eficácia conforme os requerimentos técnicos e regulatórios vigentes", informou a agência, em comunicado.
No procedimento de submissão contínua, os dados técnicos deverão ser encaminhados à Anvisa conforme forem gerados. Assim, as empresas interessadas no registro de vacinas não precisam ter em mãos todos os documentos reunidos para apresentá-los ao órgão regulador.
Em entrevista à GloboNews, o gerente geral de medicamentos da Anvisa, Gustavo Mendes, explicou que o tempo que pode ser ganho com a medida depende da quantidade de dados que forem disponibilizados pelas empresas ao longo do processo.
"Quanto mais eles mandarem antes e quanto menos sobrarem para o final, mais tempo a gente ganha no procedimento de análise do dossiê", disse
Ele explicou que, normalmente, o prazo de análise para vacinas pela Anvisa é de um ano. Porém, por causa da pandemia, o imunizante de covid-19 teve a previsão diminuída.
"Se não tivesse o procedimento de submissão contínua, nossa expectativa seria de 60 dias. Com a publicação da decisão, acreditamos que podemos reduzir tempo. Mas isso depende de quanto a empresa vai mandar. Se ela mandar 50%, a gente teria uma redução de 50% no tempo", exemplificou.
Submissão contínua
Esse procedimento será normatizado apenas para as vacinas contra covid-19 a serem registradas no país. Segundo a Anvisa, outras autoridades regulatórias de referência, como a dos Estados Unidos, da Europa, da Suíça e da China, já utilizam a submissão contínua em situações específicas.
A proposta da Anvisa prevê o atendimento a dois critérios para uso desse procedimento diferenciado. Um deles se refere à exigência de um dossiê de desenvolvimento clínico de medicamento referente à vacina proposta, protocolado na agência. Outro critério é que a pesquisa esteja em fase 3 de desenvolvimento clínico.
As vacinas que tiverem a análise iniciada pelo procedimento de submissão contínua poderão ser submetidas ao pedido de registro formal após a conclusão da análise do último aditamento protocolado.
Além disso, a empresa deve ter dados suficientes de qualidade, eficácia e segurança para o estabelecimento de uma relação positiva de benefício e risco da vacina, considerando a indicação terapêutica solicitada à Anvisa.
A instrução normativa publicada hoje regulamenta artigo da Resolução nº 55/2010 da Anvisa, que diz que a empresa solicitante do registro poderá procurar a Coordenação de Produtos Biológicos para discutir aspectos relacionados ao desenvolvimento do produto, antes da submissão da documentação de registro.
*Com informações da Agência Brasil












ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.