Anvisa suspende análise do uso emergencial da Covaxin por falta de dados
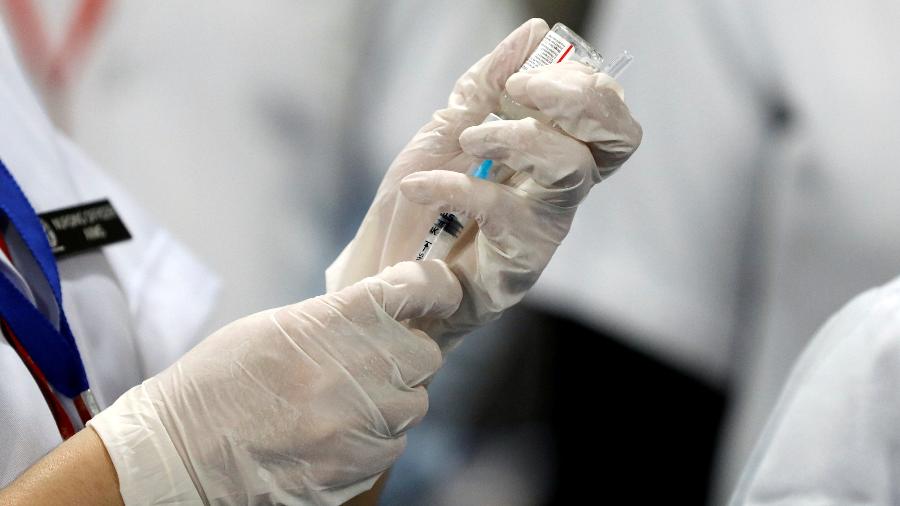
A Anvisa (Agência Nacional de Vigilância Sanitária) suspendeu hoje o prazo para concluir a análise do pedido de uso emergencial da vacina Covaxin, desenvolvida pelo laboratório indiano Bharat e Biotech, cujo contrato de compra é alvo de suspeitas de irregularidades.
A decisão foi tomada após a agência verificar que documentos obrigatórios para avaliação da eficácia e da segurança da vacina "foram apresentados apenas parcialmente ou não foram localizados", segundo explicou a Anvisa em nota.
A agência já notificou a Precisa Medicamentos, que representa a Bharat Biotech no Brasil, para que providencie as informações pendentes com urgência. Também foram solicitados esclarecimentos e complementação de dados referentes ao texto da bula proposto para a Covaxin.
Entre os documentos em falta, estão os dados de segurança dos estudos de fase 1 e 2, com foco nos eventos adversos graves, eventos adversos de interesse especial e casos graves de covid-19. De acordo com a Anvisa, as informações enviadas "foram apresentados de forma muito resumida", sem os detalhes exigidos pela agência.
Os dados pendentes, segundo a Anvisa, são:
- informações sobre qualidade e tecnologia farmacêutica para substância ativa e produto terminado;
- relatório de estudos pré-clínicos de segurança e imunogenicidade;
- relatório de imunogenicidade contendo os resultados dos parâmetros imunológicos avaliados nos estudos clínicos;
- relatórios do (s) estudo (s) clínico (s) que incluam os resultados da análise interina ou final de desfecho primário do (s) estudo (s) clínico (s) de fase 3;
- relatórios de validação dos ensaios bioanalíticos utilizados para avaliar os desfechos do estudo clínico de fase 3;
- dados de segurança acumulados dos estudos de fase 1 e 2, com foco nos eventos adversos graves, eventos adversos de interesse especial e casos graves de covid-19, acompanhados das respectivas narrativas detalhadas, e o plano de monitoramento para detecção de eventos adversos tardios, justificando o período proposto;
- dados de segurança dos estudos de fase 3 referentes a um seguimento mediano de, pelo menos, dois meses após a última imunização e estabelecimento de um perfil de segurança preliminar para eventos adversos graves e de interesse especial;
- dados de eficácia e de segurança de análises de subgrupos por status de infecção prévia e por faixas etárias.
Envio por "nuvem"
À Anvisa, a Precisa Medicamentos explicou que as informações sobre qualidade e tecnologia farmacêutica, o relatório de estudos pré-clínicos de segurança e imunogenicidade e o relatório de imunogenicidade foram encaminhados por meio de um link externo, uma vez que os arquivos tinham tamanho maior do que o aceito pelo sistema da agência.
Mas, de acordo com a Anvisa, a empresa não enviou as orientações necessárias para acessar a nuvem. Além disso, a agência não aceita documentos encaminhados por links externos, já que "não se pode assegurar a integridade do que foi apresentado no momento da submissão".
A Precisa foi orientada pela Anvisa a dividir os arquivos e apresentá-los formalmente no sistema da agência.
O pedido de autorização para uso emergencial foi apresentado em meio às investigações da CPI da Covid e de órgãos de controle sobre suspeitas de irregularidades envolvendo as tratativas com o governo federal para compra da Covaxin. O contrato foi suspenso ontem pelo Ministério da Saúde para "apuração".
Essas suspeitas levaram o presidente Jair Bolsonaro (sem partido) para o centro do debate na CPI. Segundo o deputado federal Luis Miranda (DEM-DF), que já depôs à comissão, ele teria sido informado das suspeitas e dito que investigaria o caso — o que não aconteceu.
(Com Reuters)














ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.