Anvisa aprova registro de vacina contra covid-19 da farmacêutica Moderna
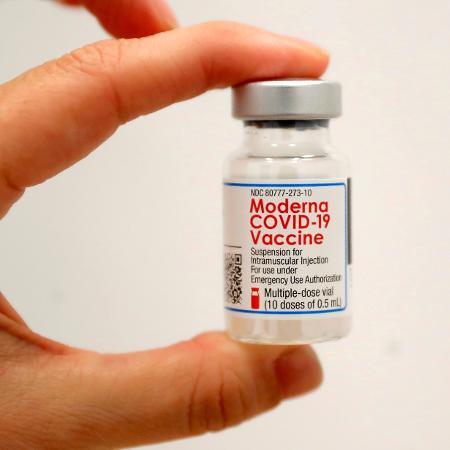
A Anvisa aprovou, nesta quarta-feira (6), o registro da vacina Spikevax, da farmacêutica Moderna. Trata-se de um imunizante monovalente contra a covid-19 já atualizado para a variante XBB 1.5, a que está em maior circulação atualmente. O registro é o padrão ouro de avaliação, com base em dados consolidados.
O produto é registrado pela Adium e fabricado pela Moderna. A submissão foi realizada em agosto passado, após órgãos regulatórios e entidades globais de saúde pública recomendarem o desenvolvimento de uma vacina monovalente XBB 1.5.
Conforme comunicado da Adium, a vacina utiliza "plataforma mRNA que permite rápida atualização, assim acompanhando as mutações do Sars-CoV-2. Essa tecnologia vem sendo estudada pela Moderna há mais de 10 anos e possui potencial de aplicação para diversas finalidades, como terapias oncológicas e outras doenças infecciosas".
Esta é a segunda vacina monovalente atualizada com essa variante autorizada pela Anvisa. A Spikevax foi originalmente aprovada na sua versão bivalente.
Vale ressaltar que a Anvisa possui um pedido para atualização de outra vacina monovalente, para a variante XBB 1.5 que se encontra em análise.
A vacina está indicada para imunização ativa para a prevenção da covid-19 para todos os públicos. A posologia e quantidade de doses por idade e estado de saúde podem ser conferidas no site da Anvisa.
Próximo passo
Após a constatação da OMS (Organização Mundial da Saúde) sobre a cepa ancestral e variantes relacionadas, que deixaram de circular, órgãos regulatórios e agências globais de saúde pública recomendaram que as vacinas covid-19 fossem atualizadas para uma composição monovalente XBB.1.5.
Por isso a Moderna tem gerado dados clínicos e pré-clínicos de sua vacina monovalente XBB.1.5, demonstrando resposta imune contra linhagens XBB, XBB.1.5, XBB.1.16 e XBB.2.3.2, além das variantes EG.5, FL.1.5.1, BA.2.86, JN.1, HK.3.1 e HV.1.
Segundo o diretor comercial da Adium, Thiago Barbosa, o próximo passo é a definição do preço pela CMED (Câmara de Regulação do Mercado de Medicamentos) para que o imunizante possa ser disponibilizado ao mercado nacional.


















Deixe seu comentário