Anvisa nega autorização para uso emergencial do Avifavir contra covid
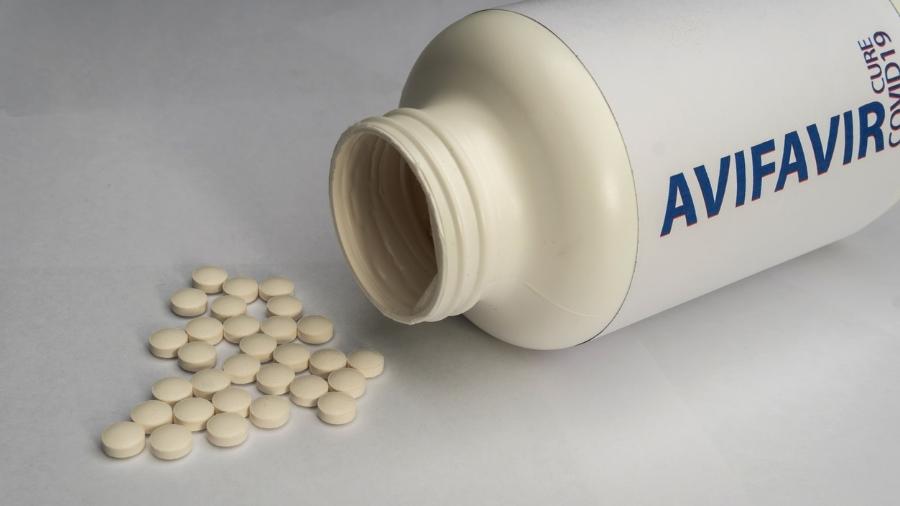
A Anvisa (Agência Nacional de Vigilância Sanitária) negou hoje autorização temporária de uso emergencial do medicamento Avifavir para o tratamento antiviral de pacientes hospitalizados com covid-19. A decisão foi unânime.
A relatora da pauta, diretora Meiruze Freitas, afirmou que o medicamento não atende aos requisitos mínimos de segurança e eficácia exigidos pela Anvisa para uso emergencial, mas ressaltou o comprometimento da agência "com o avanço da saúde pública do país durante esta pandemia sem precedentes".
Não se pode autorizar o uso de um medicamento que não demonstrou benefício clínico no tratamento da covid-19 e ainda pode resultar em riscos à saúde dos pacientes."
Diretora Meiruze Freita justifica voto
O Avifavir ainda não foi autorizado por nenhuma agência regulatória do mundo para o tratamento da covid. No Brasil, o IFA (insumo farmacêutico ativo) do medicamento também não é registrado pela Anvisa.
A decisão unânime dos diretores seguiu avaliação dos técnicos da Anvisa, que consideraram que as incertezas e riscos da aprovação do uso emergencial do Avifavir superam os benefícios no tratamento de pacientes com covid.
Em março, a Anvisa autorizou o primeiro registro para um medicamento com uso indicado em bula para tratamento da doença, o rendesivir, da farmacêutica Gilead.
Na época, a Anvisa considerou que o medicamento é uma terapia válida por ter diminuído o tempo de hospitalização e o uso de suporte de oxigênio, ressaltando que agências reguladoras "de destaque" aprovaram seu uso —o medicamento só pode ser administrado em ambiente hospitalar e não é comercializado em farmácias.
Em nota, o Instituto Vital Brasil, representante do medicamento no Brasil, afirma que enviou relatórios técnicos para sanar os questionamentos da Agência. O Instituto também rechaçou a informação de que o medicamento não está registrado em outros países.
Leia na íntegra:
A gestão atual do Instituto Vital Brazil informa que vem trabalhando incansavelmente para apresentar soluções de enfrentamento à pandemia da Covid-19.
Sobre o Avifavir, em dezembro de 2020, o Instituto iniciou o alinhamento de uma estratégia para o pedido de autorização de uso emergencial do medicamento. Ao longo de meses, a parceria com a Belcher e a fabricante Chromis foi amadurecida e, em 26 de abril deste ano, um dossiê de registro sanitário do produto foi finalizado de maneira satisfatória para o peticionamento à Agência Nacional de Vigilância Sanitária (Anvisa).
A Anvisa, em caráter colaborativo, flexibilizou alguns aspectos regulatórios para registro de medicamentos e vacinas, através da publicação da RDC 475/2021. Tal documento gerou o cenário ideal para que o medicamento Avifavir pudesse atender satisfatoriamente às normas sanitárias vigentes.
Em reuniões técnicas entre o Instituto Vital Brazil, a fabricante russa Chromis, a parceira nacional Belcher e a Anvisa, os técnicos do Instituto visualizaram processos que necessitavam ser equalizados para que houvesse uma harmonização dos parâmetros sanitários elencados pelo Brasil e pela Rússia, o que gerou uma alta complexidade na avaliação do pedido de Autorização para Uso Emergencial (AUE) do Avifavir.
Após a deliberação que nega o pedido da AUE do Avifavir ao Instituto, compartilhamos os relatórios técnicos da Anvisa com a empresa parceira fabricante Chromis, que já está avaliando os pontos apresentados como insatisfatórios e providenciando as respostas técnicas necessárias que possam vir a sanar os questionamentos da Anvisa.
É importante salientar que a Anvisa conseguiu organizar sua agenda e inspecionou prontamente a unidade fabril da Chromis na Rússia. O período de pré-inspeção e inspeção durou aproximadamente 10 dias corridos e todos os envolvidos da Anvisa, da Chromis e do Instituto não mediram esforços para atender à agenda de inspeção. Após a inspeção, o Instituto encaminhou um plano de ação à Anvisa e uma equipe técnica da Chromis está trabalhando em cima do parecer final dos inspetores.
Outra coisa importante de ser ressaltada é que, embora a matéria no site da Anvisa informe que "Até o momento, nenhuma autoridade regulatória no mundo aprovou o Avifavir (Favipiravir) para o tratamento da Covid-19", o relatório técnico disponível nesta mesma matéria aponta que o Avifavir está registrado ou com autorização de uso em 9 países diferentes."










ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.