Anvisa pede à Pfizer dados de estudos que orientam uso de terceira dose
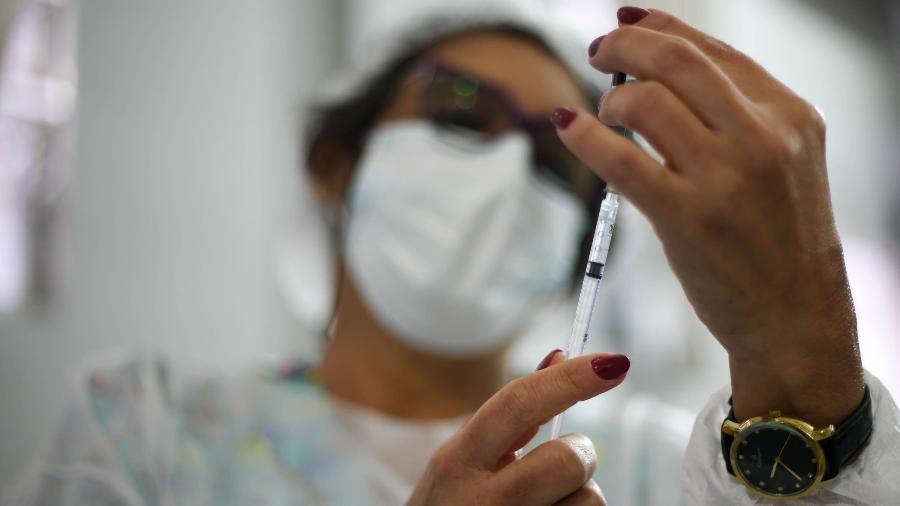
A Anvisa (Agência Nacional de Vigilância Sanitária) solicitou esclarecimentos ao laboratório farmacêutico Pfizer sobre os estudos relacionados à terceira dose da vacina contra a covid-19, a Comirnaty. A Pfizer recebeu em 10 de julho deste ano a autorização para conduzir um estudo clínico de avaliação da eficácia e segurança da aplicação de uma terceira dose da vacina.
Segundo informações divulgadas pelo órgão, o intuito é identificar dados que embasaram a decisão do FDA, agência reguladora de saúde dos Estados Unidos, que autorizou a aplicação da terceira dose do imunizante para os pacientes transplantados ou imunocomprometidos.
No ofício, a Anvisa solicita dados sobre a participação da Pfizer na condução desses estudos e os resultados gerados até o momento.
Além disso, a agência propôs uma reunião com a Pfizer, na próxima semana, para aprofundar a discussão sobre terceira dose ou doses de reforço para imunizar a população contra o coronavírus.
Estudos sobre doses de reforço
No Brasil, a Anvisa aprovou três pedidos formais para avaliar a necessidade ou não de uma terceira dose — ou dose de reforço — de vacinas que atuam no combate à covid-19.
O primeiro é um estudo da Pfizer/BioNTech que investiga os efeitos, a segurança e o benefício de uma dose de reforço da sua vacina, a Comirnaty.
A Anvisa esclareceu que nesse estudo, a dose de reforço da vacina da Pfizer será aplicada em pessoas que tomaram as duas doses completas do produto há pelo menos seis meses.
O segundo estudo está sendo conduzido pelo laboratório AstraZeneca, que desenvolveu uma segunda versão da vacina AZD2816, que está em uso no país. O objetivo é a imunização contra a variante B.1.351, identificada primeiro na África do Sul.
O terceiro é um estudo clínico para avaliar a segurança, a eficácia e a imunogenicidade de uma terceira dose da versão original da vacina da AstraZeneca — AZD1222 — em participantes do estudo inicial que já haviam recebido as duas doses do imunizante, com um intervalo de quatro semanas entre as aplicações.
A condução do andamento dos estudos é realizado pelos laboratórios de cada um dos patrocinadores dos imunizantes, segundo a Anvisa.













ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.