Anvisa autoriza início da aplicação da vacina ButanVac em voluntários

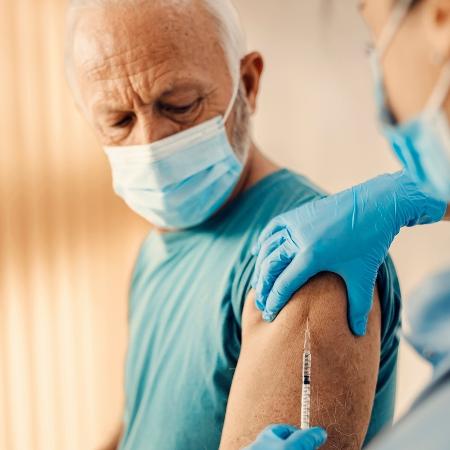
A Anvisa (Agência Nacional de Vigilância Sanitária) autorizou hoje o início da vacinação de voluntários do estudo clínico da vacina ButanVac. A decisão foi tomada após reunião entre a equipe técnica da Anvisa com o Instituto Butantan, quando foram apresentados os dados pendentes para o início dos testes.
A equipe técnica da Anvisa considerou os dados suficientes para que o estudo seja realizado. A autorização permite que o Instituto Butantan inicie a aplicação do vacina candidata nos voluntários.
O protocolo clínico da ButanVac já havia sido aprovado pela Anvisa no dia 9 de junho, mas ainda faltavam informações para poder iniciar os testes em humanos, apesar de o protocolo do estudo já estar aprovado. A agência avaliava a segurança clínica da vacina e possíveis efeitos adversos.
O pedido de aprovação do estudo foi protocolado na Conep (Comissão Nacional de Ética em Pesquisa), órgão pertencente ao CNS (Conselho Nacional de Saúde), em 22 de junho. Dois dias depois, a comissão pediu novos dados.
A ButanVac é diferente da CoronaVac, vacina desenvolvida pelo laboratório chinês Sinovac e distribuída no Brasil pelo Butantan. Segundo o instituto, o imunizante em fase de estudo será totalmente produzido em território brasileiro e não dependerá da importação do IFA (insumo farmacêutico ativo) do país asiático.










ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.