Pfizer deve submeter dados de estudo de vacina ao FDA até fim de novembro
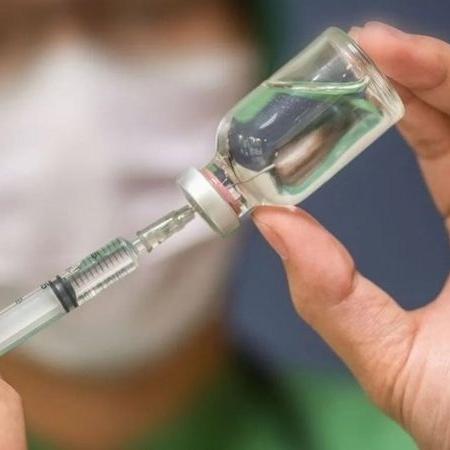
Marjóri Dulcine, diretora-médica da Pfizer no Brasil, afirmou hoje (29) que a farmacêutica deve submeter os dados de estudo fase 3 da vacina contra o coronavírus ao FDA —órgão regulador dos EUA— na terceira semana de novembro. A afirmação foi feita durante encontro online com jornalistas.
"O FDA é o primeiro órgão que vai receber os dados por que eles têm um padrão de uso emergencial, diferentemente do Brasil, que ainda não tem esse uso", explicou. A médica ainda reafirmou que existe uma exigência de saúde pública pelo momento que estamos passando e que "tudo que está sendo feito está respeitando os mais altos padrões de qualidade".
"Por ser uma pandemia, é possível concentrar mais rapidamente o estudo e avaliar o quão eficaz poderia ser uma vacina num menor espaço de tempo. É possível ir mais rápido por causa da característica da própria pandemia", afirmou Dulcine. A vacina da Pfizer é uma das quatro que está sendo testada no Brasil em fase 3. No caso da farmacêutica americana, cerca de 3.000 voluntários estão envolvidos na pesquisa.
Ontem, os executivos da Pfizer expressaram otimismo sobre a perspectiva de fornecer uma vacina contra o novo coronavírus ainda em 2020. O presidente-executivo, Albert Bourla, disse que a empresa poderia fornecer cerca de 40 milhões de doses nos Estados Unidos este ano se os testes clínicos prosseguissem conforme o esperado e os reguladores aprovassem uma vacina.
"Se tudo correr bem, estaremos prontos para distribuir um número inicial de doses", afirmou Bourla, que mencionou um contrato do governo americano com a Pfizer para fornecer 40 milhões de doses até o final deste ano e 100 milhões de doses até março de 2021.
No entanto, Bourla ressaltou que a empresa ainda não atingiu os principais parâmetros de referência na avaliação da eficácia da vacina. A Pfizer havia declarado anteriormente que poderia ter os dados em outubro.
O CEO disse que a empresa espera solicitar autorização de uso emergencial para sua vacina da covid-19 na terceira semana de novembro, quase de acordo com os cronogramas anteriores.
Questionado se estava "certo" de que a vacina funcionaria, Bourla afirmou: "Não estou otimista de que a vacina funcionará. Estou cautelosamente otimista de que a vacina funcionará". (Com informações da Reuters)











ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.