Texto baseado no relato de acontecimentos, mas contextualizado a partir do conhecimento do jornalista sobre o tema; pode incluir interpretações do jornalista sobre os fatos.
Por que ficar de olho no genoma do Sars-CoV-2 fará diferença na nossa vida
Receba os novos posts desta coluna no seu e-mail
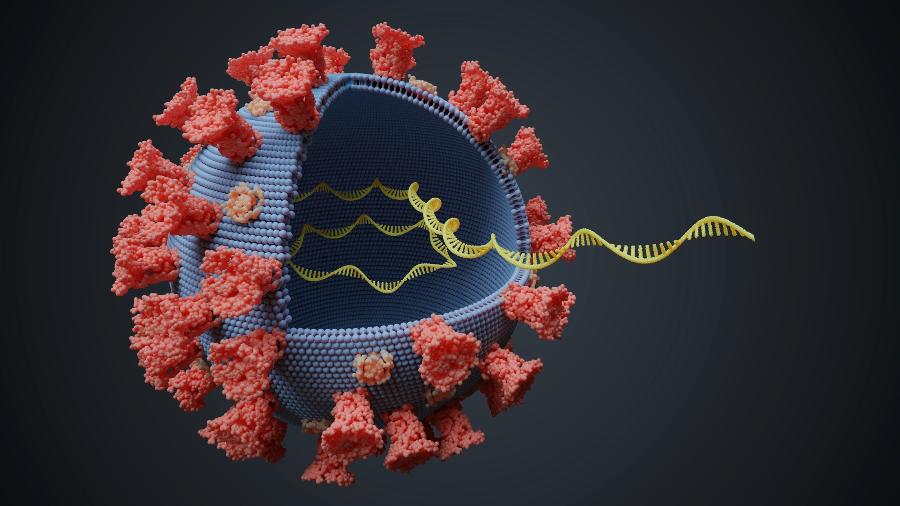
Dizem que, perto de outros, o Sars-CoV 2 é até um vírus lento. Na sequência de 30 mil letrinhas que escrevem o seu código genético, contando tudo aquilo que ele é ou que deixa de ser, só uma ou duas trocam de posição a cada trinta dias.
Olhar para o passado e ver o que saiu do lugar há quatro meses não faz muita diferença. Você pode constatar uma variante do novo coronavírus mais ameaçadora apenas no instante em que já deu tempo para ela se tornar a dona pedaço.
Porque esse vírus, apesar de aparentar ser tão lerdo, é tremendamente eficaz nas mudanças que faz em sua sequência de DNA. Cada letra movida em sua fitinha genética é feito uma peça de xadrez em sua estratégia para se perpetuar aqui na Terra. Ele aprimora a sua capacidade de passar de uma pessoa para outra, de infectar as células humanas ligeiro ou de, ao final do dia, ser mais agressivo.
Portanto, o ideal seria que os cientistas chegassem com a observação de qualquer novidade quase junto com o surgimento da mesma, avançando no conhecimento do Sars-CoV 2 no mesmo ritmo com que brotam suas variantes.
Isso significa fazer vigilância genômica: ficar de olho na sequência do seu DNA em todas as regiões do país, continuamente, fornecendo dados em tempo real.
É o que fará toda a diferença para a gente saber se dá para continuar confiando nesse ou naquele teste de diagnóstico, para orientar políticas públicas de contenção da pandemia, isolar depressa casos mais complicados e para criar vacinas ou melhorar as já existentes.
Essa perspectiva é tão fantástica que, não à toa, o biólogo molecular e virologista José Eduardo Levi revela: "Estou vivendo um sonho dentro de um pesadelo". À frente da área de pesquisa e desenvolvimento da Dasa, uma das principais redes de saúde integrada do país, foi ele quem idealizou um projeto ambicioso de vigilância genômica, batizado Genov.
A empresa anunciou ontem que, nos próximos doze meses, pretende sequenciar 30 mil genes do novo coronavírus — genoma é o sequenciamento completo do DNA de um organismo. Isso é seis vezes mais do que o Brasil conseguiu fazer desde o início da pandemia.
E detalhe: o sequenciamento que realizamos até o momento, representando ínfimo 0,03% dos casos de covid-19 no país, tinha aquele delay, retratando um vírus que, no presente, já está em outra. Ou melhor, mutado.
O Reino Unido, exemplar no quesito vigilância genômica, já sequenciou perto de 5% das amostras de quem se infectou por lá. Essa é uma boa porcentagem.
"Aqui serão 3 mil amostras das mais diversas regiões do país por mês. Não adiantaria fazer tudo de uma vez. A vigilância precisa ser constante", avisa o pesquisador, na liderança da iniciativa que conta, ainda, com um comitê formado por alguns dos maiores cientistas brasileiros de outras instituições.
Amanhã, adeus PCR?
No passado, como me conta Levi, os diagnósticos das infecções eram na base de olhar pelo microscópico e ver. Então veio uma fase longa, a da sorologia. "Nela, o que identifico por meio de exames são anticorpos que as defesas formaram contra determinada doença", explica.
A partir dos primeiros anos 2000, porém, os cientistas passaram a usar testes para identificar o material genético de um vírus, por exemplo, flagrando a sua presença propriamente e não a reação do organismo à sua passagem. O mais famoso teste, fruto dessa era, é o de PCR. "Ele permite dizer que, sim, achamos um pedacinho do vírus em seu nariz. Logo, você está infectado por ele", descreve Levi.
O "pedacinho" que o PCR reconhece, na verdade, é uma sequência de 20 a 40 nucleotídeos ou unidades do DNA. Mas lembre-se: o coronavírus tem 30 mil nucleotídeos. Daí que esse tipo de exame não é um sequenciamento, que listaria na ordem exata do primeiro ao último nucleotídeo.
A ciência levou 20 anos para fazer o sequenciamento do genoma humano, iniciado em 1990. Hoje isso é inimaginável. "Em laboratórios como os nossos, fazemos o sequenciamento de dez a 100 genomas em apenas 36 horas", conta Levi, que é também professor colaborador do Instituto de Medicina Tropical da USP (Universidade de São Paulo).
Para ele, em um futuro nem tão distante o diagnóstico de toda virose será feito por meio de sequenciamento. Então, você não saberá apenas que carrega um vírus, mas detalhes do vírus que carrega.
Vigilância é outro conceito
Pensando no controle de uma pandemia, a história é outra, embora a sua base também seja o sequenciamento. "Não adianta eu saber que alguém tem o agente infecioso, mas o que interessa é perceber se esse agente está se diversificando", diz Levi.
No Brasil, lembra Levi, temos uma vigilância muito bem feita na área de HIV. "Mas, no caso, ela é focada em pessoas que apresentam sinais de resistência ao tratamento", conta. "Então, a gente não sequencia o genoma inteiro do vírus da Aids e, sim, apenas a região que é alvo das drogas antirretrovirais para ver se alguma mutação ali está atrapalhando a ação dos remédios." Ok, mas não deixa de ser uma vigilância.
Na covid-19
Já os sequenciamentos iniciais do Sars-CoV 2 tinham o intuito de acompanhar as suas rotas de transmissão. "Em março do ano passado, ficou claro que nos primeiros infectados brasileiros o vírus tinha vindo da Itália", recorda Levi. "Poderia ser o caso de redobrar a atenção com os viajantes vindos desse país, para dar um exemplo."
Agora, o que mais interessa são as mutações. O Sars-CoV 2, que já as acumula de montão — só no Brasil, circulam mais de 100 variantes, a maioria sem fazer muita diferença em ruindade para nós. A partir do final do ano passado, porém, a coisa mudou de figura. Então, Boris Johnson anunciou uma variante na Inglaterra que parecia se expandir em velocidade estonteante.
A fala do primeiro-ministro britânico chamou tanta atenção que, talvez, tenha ofuscado o fato de que, um dia antes, o sul-africanos também anunciaram uma variante com terríveis vantagens competitivas.
Detalhe que o sequenciamento genômico mostrou: ambas tinham uma mutação em comum. Não, não foi um inglês que levou a sua variante para a África do Sul, nem vice-versa. Isso é o que os cientistas chamam de evolução convergente. Ou seja: em cantos diferentes do planeta, o vírus cria mutações por tentativa e erro, até emplacar alguma que faça ele se reproduzir com maior eficiência. E, claro, fixa a que deu certo.
Meta do Sars-CoV 2: aumentar a carga viral
Para o coronavírus se reproduzir, ele precisa usar a nossa maquinaria celular. Mas ela tem seus limites. "Você não vai encontrar uma célula com capacidade aumentada de produzir réplicas virais", nota Levi.
Daí que, para o Sars-CoV 2 aumentar sua carga viral no organismo, ele só acha um jeito: infectar um número maior células. E todas as mutações na famosa proteína S que ele usa como chave para entrar nelas têm o objetivo de torná-lo mais competente para destrancá-las correndo, vamos falar assim.
"As cargas virais da covid-19 são as maiores que já vi na vida", garante o cientista, do alto de trinta anos de experiência diagnosticando viroses. "São bilhões de partículas virais só na mucosa do nariz", informa.
As variantes que mais preocupam o mundo no momento — a britânica, a sul-africana, a nossa de Manaus e agora a indiana — produzem cargas virais de dez a cem vezes maiores do que as outras, que já eram descomunais.
Para escapar dos anticorpos
Esse é outro bloco das mutações observadas no Sars-CoV 2. "A variante britânica jogou fora seis letrinhas de sua proteína S", exemplifica Levi. "O vírus do Amazonas, quando fomos ver, deletou essa mesma sequência."
Por que raios um vírus apagaria um pedaço do seu código genético? "Porque era justamente a porção reconhecida pelos anticorpos humanos", conta o pesquisador. Portanto, ou o vírus se torna cada vez melhor na transmissão ou na capacidade de escapar. E aí vem o medo: que ele acabe escapando da vacina também.
Iniciativa bem-vinda
A vigilância genômica é preciosa para que se combinem informações de versões diversas do Sars-CoV 2 a fim de criar vacinas polivalentes, contra algumas variantes ao mesmo tempo. "Também é fundamental checarmos se todos os métodos de diagnóstico que dispomos, continuam eficazes diante das variantes emergentes", acrescenta Levi.
Importante: o Genov não ficará restrito à Dasa. "Os dados serão de domínio público, imediatamente, para que todos possam fazer o melhor uso", assegura Gustavo Campana, diretor médico da empresa. Inclusive, eles alimentarão o GISAID, o banco global com informações do genoma do Sars-CoV2. De fato, é preciso mesmo que o mundo sincronize as informações — habilidade que a natureza do vírus, na tal convergência de evolução, tem de sobra.











ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.