Saiu na Nature: como pesquisa brasileira ajudará a vencer as superbactérias
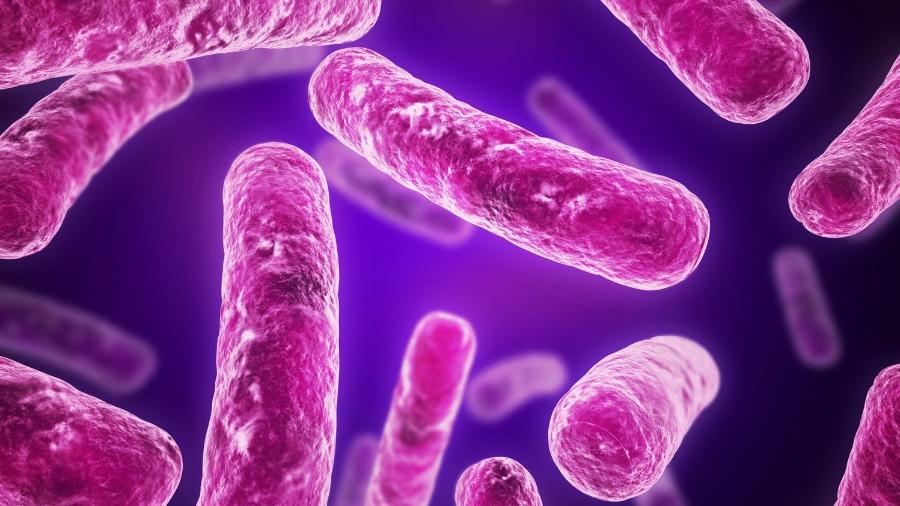
Pesquisadores do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), do Ministério da Ciência, Tecnologia e Inovações, e do Instituto de Biologia Estrutural (IBS), da França, estão tentando desvendar os mecanismos que tornam algumas bactérias mais resistentes que outras.
As descobertas do estudo podem levar ao desenvolvimento de superantibióticos contra doenças agressivas como pneumonias e infecções hospitalares. O trabalho foi publicado na semana passada na renomada revista científica Nature Communications.
Os cientistas brasileiros trabalham nesta pesquisa há quase uma década, com a intenção de compreender a formação da parede celular das bactérias do tipo bacilo, a nível molecular e atômico.
O objetivo é explicar os mecanismos que criam as superbactérias resistentes a antibióticos. Ao descobrir os pontos fracos do processo, será possível criar novos medicamentos, mais eficientes e específicos.
O trabalho revela como a proteína MreC, essencial na formação da parede celular de bactérias alongadas —os chamados bacilos—, é capaz de se auto-associar e organizar, em forma de filamentos e até tubos.
No estudo foi utilizada a bactéria Pseudomonas aeruginosa, uma das principais responsáveis por casos de infecção hospitalar, com altas taxas de mortalidade, e naturalmente resistente aos antibióticos disponíveis no mercado.
"Estas estruturas nos permitiram descobrir regiões de MreC que são importantes para a estabilidade dos tubos e para a regulação da formação da parede celular bacteriana. Portanto, estes resultados nos proporcionaram informações valiosas para o eventual desenvolvimento de antibióticos que interrompam o processo de auto-associação e provoquem a morte das bactérias", explica a pesquisadora Andréa Dessen.
Os filamentos de proteína foram analisados por criomicroscopia eletrônica e cristalografia, além de testes microbiológicos. A cristalografia por difração de raio-X é uma avançada técnica que consiste em cristalizar proteínas e observar como esse cristal difrata a radiação emitida sobre ele —e foi toda realizada no Brasil.
Para mapear e compreender em detalhe atômico todo o complexo proteico —chamado elongassomo, constituído por cerca de dez proteínas diferentes, que protege e dá o formato alongado dos bacilos—, a equipe também pretende usar fontes de luz síncrotron de última geração. Para isso será usado o mais avançado acelerador de partículas brasileiro, o Sirius, no CNPEM, em Campinas (SP).
Os cientistas também geraram versões mutantes da MreC, com alterações nos aminoácidos situados nas regiões de interação da proteína. Nos testes, observaram que, dependendo de como a proteína era modificada, não seria mais capaz de interagir com outras para formar o complexo.
"In vitro, as mutações causam uma consequência drástica para a formação dos tubos. Em paralelo, quando introduzimos as mesmas mutações diretamente no genoma bacteriano, observamos a diminuição da quantidade de MreC produzida, indicando um efeito direto na estabilização do elongassomo", explica Dessen.
Ficou provado que a alteração da MreC afeta o formato da parede celular das bactéricas. Se não conseguirem se alongar até um formato de cápsula, elas não sobrevivem.
As estruturas estudadas são comuns a outras perigosas bactérias de formato alongado (bacilos gram-negativos), como a Escherichia coli —uma das principais responsáveis por quadros graves de diarreia— e a Helicobacter pylori —associada ao desenvolvimento de úlceras e câncer gástrico.
Se conseguirmos desestabilizar a formação de seus elongassomos, especialmente bloqueando a ação da MreC, os microrganismos não conseguirão assumir o formato alongado e morrerão. O desafio, agora, é buscar moléculas capazes de interromper a interação entre essas proteínas.
A pesquisa internacional agora prossegue em outras frentes, também com parceria de pesquisadores da Eslovênia, para buscar moléculas que demonstrem capacidade de inibir a formação do complexo de proteínas da parede celular bacteriana.
A busca por novos antibióticos potenciais também conta com estudos realizados com compostos naturais da biodiversidade brasileira, graças a colaborações do CNPEM com a USP (Universidade de São Paulo), a Univali (Universidade do Vale do Itajaí, em SC) e a empresa Phytobios.
A interação entre os grupos do Brasil e de outros países acontece com apoio da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp).



















ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.